TIPOS DE ENLACES QUE EXISTEN
Como dijimos al principio, el hecho de que los átomos se combinen o enlacen para formar nuevas sustancias se explica por la tendencia a conformar estructuras más estables. De ahí que dichos enlaces químicos sean considerados como un incremento de estabilidad.
Para lograr ese estado ideal estable, los átomos pueden utilizar algún método que les acomode, eligiendo entre: ceder o captar electrones, compartir electrones con otro átomo o ponerlos en común junto con otros muchos.
De estas tres posibilidades nacen los tres tipos de enlace químico: iónico, covalente y metálico.
Tomando como base la diferencia de electronegatividad entre los átomos que forman un enlace se puede predecir el tipo de enlace que se formará:
| Si la diferencia de electronegatividades es mayor que 2. |
=
|
se formará un enlace iónico
|
Si la diferencia de electronegatividades es mayor que 0,5 y menor a 2,0.
|
=
|
el enlace formado será covalente polar
|
Si la diferencia de electronegatividades es menor a 0,5
|
=
|
el enlace será covalente puro (o no polar).
|
Enlance Ionico:
Es la union que resulta de la presencia de de fuerzas de atraccion electrostatica entre iones de distinto signo. Se da cuando uno de los atomos capta electrones del otro. Un electron abandona al atomo menos electronegativo y pasa a formar parte de la nube del mas electronegativo, de esta manera se crea dos iones de carga contraria (cation y anion). La diferencia de carga de los iones provoca una fuerza
de interaccion electromagnetica que mantiene unidos a los dos atomos. Metal con No-Metal
Características:
* Conduce la corriente electrica.
* Tiene punto de ebullicion y fusion alto
* Se disuelve con facilidad en disolventes polares
* En estado solido es cristalino
Ejemplos:
- Cloruro de Sodio (NaCl)
- Cloruro de Potasio (KCl)
- Ioduro de Potasio (KI)
- Oxido de Hierro (FeO)
- Cloruro de Plata (AgCl)
- Oxido de Calcio (CaO)
- Bromuro de Potasio (KBr)
- Oxido de Zinc (ZnO)
- Oxido de Berilio (BeO)
- Cloruro de Cobre (CuCl2)
Enlace metálico
Si los átomos enlazados son elementos metálicos, el enlace se llama metálico. Los electrones son compartidos por los átomos, pero pueden moverse a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad.
Los electrones que participan en él se mueven libremente, a causa de la poca fuerza de atracción del núcleo sobre los electrones de su periferia.
Cuando los electrones son compartidos simétricamente, el enlace puede ser metálico o covalente apolar; si son compartidos asimétricamente, el enlace es covalente polar; la transferencia de electrones proporciona enlace iónico. Generalmente, la tendencia a una distribución desigual de los electrones entre un par de átomos aumenta cuanto más separados están en la tabla periódica.
Ejemplos:
Hierro
Cinc Paladio
Plata
Platino
Cobre
Magnesio
Sodio (inestable en contacto con la humedad, se oxida liberando calor)
Potasio (inestable en contacto con la humedad, se oxida liberando calor)
Mercurio (es el único que es líquido a T ambiente)
Enlace covalente
Se presenta cuando se comparten uno o más pares de electrones entre dos átomos cuya diferencia de electronegatividad es pequeña.
Enlace covalente apolar (o no polar)
Si los átomos enlazados son no metales e idénticos (como en N2 o en O2), los electrones son compartidos por igual por los dos átomos, y el enlace se llama covalente apolar.
Se establece entre átomos con igual electronegatividad. Átomos del mismo elemento presentan este tipo de enlace.
En este enlace covalente no polar, la densidad electrónica es simétrica con respecto a un plano perpendicular a la línea entre los dos núcleos. Esto es cierto para todas las moléculas diatómicas homonucleares (formadas por dos átomos del mismo elemento) , tales como H2, O2, N2, F2 y Cl2, porque los dos átomos idénticos tienen electronegatividades idénticas. Por lo que podemos decir:los enlaces covalentes en todas las moléculas diatómicas homonucleares deben ser no polares. Por ejemplo, una molécula de dióxido de carbono (CO2) es lineal con el átomo de carbono al centro y, por lo tanto, debido a su simetría es covalente apolar.
Ejemplos:
CH4 (metano)
CO2 (dióxido de carbono)
O2 (oxígeno)
N2 (nitrógeno)
F2 (flúor)
H2 (hidrógeno)
Cl2 (cloro)
CO2 (dióxido de carbono)
O2 (oxígeno)
N2 (nitrógeno)
F2 (flúor)
H2 (hidrógeno)
Cl2 (cloro)
Enlace covalente polar
Si los átomos son no metales pero distintos (como en el óxido nítrico, NO), los electrones son compartidos en forma desigual y el enlace se llama covalente polar (polar porque la molécula tiene un polo eléctrico positivo y otro negativo, y covalente porque los átomos comparten los electrones, aunque sea en forma desigual).
Se establece entre átomos con electronegatividades próximas pero no iguales.
Estas sustancias no conducen la electricidad ni tienen brillo, ductilidad o maleabilidad.
Veamos un ejemplo:
¿Qué tipo de enlace se formará entre H y O?
Según la Tabla de Electronegatividades de Pauli, el Hidrógeno tiene una electronegatividad de 2,2 y el Oxígeno 3,44, por lo tanto la diferencia de electronegatividades será: 3,44 – 2,2 = 1,24.
El resultado de la operación entrega 1,24 cifra que es menor que 2,0 y mayor que 0,5.
Por lo tanto, el enlace será covalente polar. Además, si no se conociera la electronegatividad de los elementos bastaría saber que son dos no metales distintos para definir su enlace como covalente polar.
Ejemplos:
H2O (agua)
NH3 (amoníaco) HCl (ácido clorhídrico)
H2S (ácido sulfhídrico)
SO2 (dióxido de azufre)
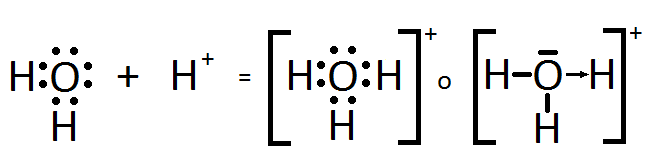
Enlace covalente coordinado
Se establece por compartición de electrones entre dos átomos, pero sólo un átomo aporta el par de electrones compartidos.
Ejemplos:
1) H20 agua
2)C02 dioxido de carbono
3) Cl2 cloro biatomico
4) BF3 floruro de bromo
5) PCl5 cloruro de fosforo.
Enlace Dipolo-Dipolo: son la fuerza que actua entre moleculas polares es decir moleculas con dipolo permanente.
Su origen es electroestatico. ejemplos: sulfuro de hidrógeno H2S , el metanol CH3OH y la glucosa C6H12O6
Enlace Dipolo-Dipolo: son la fuerza que actua entre moleculas polares es decir moleculas con dipolo permanente.
Su origen es electroestatico. ejemplos: sulfuro de hidrógeno H2S , el metanol CH3OH y la glucosa C6H12O6
Enlace por fuerza de London: es la fuerza muy debil entre dipolos no permanentes, es decir, entre un dipolo instantaneo y un dipolo inducido correspondiente a dos moleculas. Ejemplos: CO2 ,C6H6, CH4
Enlace de hidrogeno: Se produce cuando un atomo de hidrogeno se encuentra entre dos o mas atomos electronegativos estableciendo un vinculo entre ellos.
Ejemplos:
-agua (H2O)
-amoniaco (NH3)
-acido sulfhídrico (H2S)
-acido clorhidrico (HCl)
-acido bromhidrico (HBr)
-amoniaco (NH3)
-acido sulfhídrico (H2S)
-acido clorhidrico (HCl)
-acido bromhidrico (HBr)
Enlace por fuerza de London: es la fuerza muy debil entre dipolos no permanentes, es decir, entre un dipolo instantaneo y un dipolo inducido correspondiente a dos moleculas. Ejemplos: CO2 ,C6H6, CH4


No hay comentarios:
Publicar un comentario