Propiedades para la formación de enlaces
Energía de ionización:
La energía de ionización, potencial de ionización o EI es la energía necesaria para separar un electrón en su estado fundamental de un átomo, de un elemento en estado gaseoso. La reacción puede expresarse de la siguiente forma:

Siendo 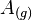 los átomos en estado gaseoso de un determinado elemento químico;
los átomos en estado gaseoso de un determinado elemento químico;  , la energía de ionización y
, la energía de ionización y 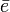 un electrón.
un electrón.
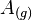 los átomos en estado gaseoso de un determinado elemento químico;
los átomos en estado gaseoso de un determinado elemento químico;  , la energía de ionización y
, la energía de ionización y 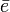 un electrón.
un electrón.
Esta energía corresponde a la primera ionización. El segundo potencial de ionización representa la energía precisa para sustraer el segundo electrón; este segundo potencial de ionización es siempre mayor que el primero, pues el volumen de un ion positivo es menor que el del átomo y la fuerza electrostática atractiva que soporta este segundo electrón es mayor en el ion positivo que en el átomo, ya que se conserva la misma carga nuclear.
El potencial o energía de ionización se expresa en electronvoltios, julios o en kilojulios por mol (kJ/mol).
1 eV = 1,6 × 10-19 C × 1 V = 1,6 × 10-19 J
En los elementos de una misma familia o grupo, el potencial de ionización disminuye a medida que aumenta el número atómico, es decir, de arriba abajo.
Sin embargo, el aumento no es continuo, pues en el caso del berilio y el nitrógeno se obtienen valores más altos que lo que podía esperarse por comparación con los otros elementos del mismo periodo. Este aumento se debe a la estabilidad que presentan las configuraciones s2 y s2 p3, respectivamente.
La energía de ionización más elevada corresponde a los gases nobles, ya que su configuración electrónica es la más estable, y por tanto habrá que proporcionar más energía para arrancar los electrones.
Afinidad Electrónica:
La afinidad eléctrica, afinidad electrónica o AE es la energía intercambiada cuando un átomo neutro, gaseoso, y en su estado fundamental, capta un electrón y se convierte en un ión mononegativo
La afinidad electrónica es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de −1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos.
La afinidad electrónica es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de −1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos.
Aunque la afinidad electrica parece variar de forma caótica y desordenada a lo largo de la tabla periódica, se pueden apreciar patrones. Los no metales tienen afinidades electrónicas más bajas que los metales, exceptuando los gases nobles que presentan valores positivos por su estabilidad química, ya que la afinidad electrónica está influenciada por la regla del octeto.
Los elementos del grupo 1, tienden a ganar un electrón y formar aniones −1, completando el subnivel s, mientras que los elementos del grupo 2, que ya lo tienen completo, no presentan esa tendencia. Análogamente sucede en el bloque p, donde las afinidades electrónicas se van haciendo más negativas a medida que nos acercamos a los gases nobles.
Existen átomos que presentan capas de valencia con lugares vacantes o "huecos", que pueden ser ocupados por electrones.
Entonces cuando a un átomo neutro se le añaden uno o más electrones se presenta un desprendimiento de energía, conocida como afinidad electrica, obteniéndose como resultado la formación de aniones.
Aunque la magnitud de dicha energía liberada sólo puede determinarse indirectamente y muy rara vez con gran exactitud, en la tabla periódica la podemos predecir en orden ascendente en un mismo período, de izquierda a derecha, y en un mismo grupo, de abajo hacia arriba.
Entonces cuando a un átomo neutro se le añaden uno o más electrones se presenta un desprendimiento de energía, conocida como afinidad electrica, obteniéndose como resultado la formación de aniones.
Aunque la magnitud de dicha energía liberada sólo puede determinarse indirectamente y muy rara vez con gran exactitud, en la tabla periódica la podemos predecir en orden ascendente en un mismo período, de izquierda a derecha, y en un mismo grupo, de abajo hacia arriba.
Electronegatividad:
La electronegatividad es una medida de la capacidad de un átomo (o de manera menos frecuente un grupo funcional) para atraer a los electrones, cuando forma un enlace químico en una molécula.También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares. El flúor es el elemento con más electronegatividad, el Francio es el elemento con menos electronegatividad.
La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su masa atómica y la distancia promedio de los electrones de valenciacon respecto al núcleo atómico. Esta propiedad se ha podido correlacionar con otras propiedades atómicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por primera vez en el año 1932, como un desarrollo más de su teoría del enlace de valencia. La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energía de ionización, pero se puede determinar de manera indirecta efectuando cálculos a partir de otras propiedades atómicas o moleculares.
Se han propuesto distintos métodos para su determinación y aunque hay pequeñas diferencias entre los resultados obtenidos todos los métodos muestran la misma tendencia periódica entre los elementos.
El procedimiento de cálculo más común es el inicialmente propuesto por Pauling. El resultado obtenido mediante este procedimiento es un número adimensional que se incluye dentro de la escala de Pauling. Esta escala varía entre 0,7 para el elemento menos electronegativo y 4,0 para el mayor.
Es interesante señalar que la electronegatividad no es estrictamente una propiedad atómica, pues se refiere a un átomo dentro de una molécula y, por tanto, puede variar ligeramente cuando varía el "entorno"4 de un mismo átomo en distintos enlaces de distintas moléculas. La propiedad equivalente de la electronegatividad para un átomo aislado sería la afinidad electrónica o electroafinidad.
Dos átomos con electronegatividades muy diferentes forman un enlace iónico. Pares de átomos con diferencias pequeñas de electronegatividad forman enlaces covalentes polares con la carga negativa en el átomo de mayor electronegatividad.
Valencia:
La valencia, es el número de electrones que tiene un elemento en su último nivel de energía, son los que pone en juego durante una reacción química o para establecer un enlace con otro elemento. Hay elementos con más de una valencia, por ello se reemplaza a este concepto con el de números de oxidación que a fin de cuentas representa lo mismo. A través del siglo XX, el concepto de valencia ha evolucionado en un amplio rango de aproximaciones para describir el enlace químico, incluyendo la estructura de Lewis(1916), la teoría del enlace de valencia (1927), la teoría de los orbitales moleculares (1928), la teoría de repulsión de pares electrónicos de la capa de valencia (1958) y todos los métodos avanzados de química cuántica.
Numero de oxidacion:
El número de oxidación es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado.
El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
El número de oxidación se escribe en números romanos (recuérdalo cuando veamos la nomenclatura de Stock): +I, +II, +III, +IV, -I, -II, -III, -IV, etc.
Se denomina número de oxidación a la carga que se le asigna a un átomo cuando los electrones de enlace se distribuyen según ciertas reglas un tanto arbitrarias.
Las reglas para colocar un numero de oxidacion son:
- El número de oxidación de todos los elementos en estado libre (no combinados con otros) es de cero (p. ej., Na, Cu, Mg, H2, O2, Cl2, N2).
- El número de oxidación del H es de +1, excepto en los hidruros metálicos, en los que es de -1 (p. ej., NaH, CaH2).
- El número de oxidación del O es de -2, excepto en los peróxidos, en los que es de -1, en los superóxidos que es -1/2 y en el OF2, donde es de +2.
- El número de oxidación del elemento metálico de un compuesto iónico es positivo.
- En los compuestos covalentes, el número de oxidación negativo se asigna al átomo más electronegativo.
- La suma algebraica de los números de oxidación de los elementos de un compuesto es cero.
- La suma algebraica de los números de oxidación de los elementos de un ion poliatómico es igual a la carga del ion




No hay comentarios:
Publicar un comentario